








 Рейтинг: 4.7/5.0 (1890 проголосовавших)
Рейтинг: 4.7/5.0 (1890 проголосовавших)Категория: Инструкции
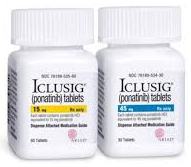
Иклусиг действующее вещество Ponatinib в аптеках Германии продается под названием Iclusig в дозировке 45 мг. Мы доставляем по всему миру и предоставляем большие скидки, а так же чек из Немецкой аптеки и сертификат качества на каждой упаковке

Действующее вещество:
Понатиниб (Ponatinib)
Форма выпуска:
таблетки, покрытые оболочкой
Производитель:
ARIAD (Германия)
Показания:
Хронический миелоидный лейкоз (ХМЛ), Острый лимфобластный лейкоз (ОЛЛ)
Понатиниб назначается после другиг лекарств, если лечение не дало нужного результата
Важная информация:
Iclusig может вызвать проблемы с сердцем, кровеносным сосудам и в последствии привести к инсульту
Позвоните своему врачу или вызовите скорую помощь. если у вас есть:
боль в груди. распространяется на челюсть или плечо, одышка, внезапное онемение или слабость, сильная головная боль, головокружение, проблемы со зрением или речью.
Iclusig также может нанести вред вашей печени. Позвоните своему врачу сразу же, если у вас есть верхний боли в животе с потерей аппетита, темная моча или желтуха (пожелтение кожи или глаз).
Прежде чем принимать это лекарствоВы не должны использовать Iclusig, если у вас аллергия на ponatinib.
Для того, чтобы убедиться, что Iclusig безопасен для вас, сообщите своему врачу, если у вас есть:
Использование Iclusig во время беременности может нанести вред зародышу (Плоду). Расскажите своему врачу, если вы беременны или если вы планируете забеременеть во время использования этого лекарства. Использование эффективного контроля рождаемости для предотвращения беременности во время лечения с Iclusig очень важен.
Не известно, проходит ли ponatinib в грудное молоко. Вы не должны кормить грудью во время использования этого лекарства.
Iclusig не одобрен для использования кем-либо моложе 18 лет.
Iclusig дозировка
Обычная доза для взрослых для хронического миелолейкоза:
45 мг перорально один раз в день
Комментарии:
-Iclusig Могут приниматься с или без пищи и таблетки следует проглатывать целиком.
-59% Пациентов требуется снижение дозы до 30 мг или 15 мг один раз в день в течение курса терапии.
Снижение дозы рассмотрят для CP CML и пациентов с ХМЛ AP, которые достигли большого цитогенетического ответа.
Вопрос о прекращении терапии рассмотрят. если за 3 месяца нет ответа от лечения
Отзывов пока нет.
3 упаковки- 6450 евро каждая
4 упаковки- 6350 евро каждая
5 упаковок- 6300 евро каждая
10 упаковок- 6200 евро каждая
Лекарство ICLUSIG 45 mg заказать в России у нашего представителя +79299595299 Лариса. Прилагается чек из Немецкой аптеки. Экспресс доставка. Оплата при получении
Iclusig 45 мг таблетки, покрытые оболочкой
Качественный и количественный состав
Каждая таблетка содержит 45 мг ponatinib (в виде гидрохлорида).
ЛЕКАРСТВЕННАЯ ФОРМА
Таблетки с пленочным покрытием (таблетка).
Белый, двояковыпуклые круглые покрытые оболочкой таблетки с диаметром около 6 мм и с
Отказ от ответственности "A5" на одной стороне
Области применения
Iclusig указывается в взрослых пациентов с
•
хронический миелолейкоз (ХМЛ) в хронической фазе, ускоренное фазы, или
Взрыв кризис, кто лечение устойчивы к дазатиниб или нилотиниба, дазатинибом
или нилотиниб не допускается, и где последующее лечение иматинибом
клинически не полезно, или там, где мутация T315I.
•
Филадельфийской хромосомы-положительных острый лимфобластный лейкоз (Ph + ALL), то
Лечение устойчивы к дазатиниб, кто не может терпеть дазатиниб и где
последующее лечение иматинибом не является клинически полезным, или если
Мутация T315I присутствует.
Смотрите раздел 4.2 для оценки состояния сердечно-сосудистой до лечения и
Раздел 4.4 к ситуации, когда альтернативное лечение можно считать
для лечения хронического миелоидного леhttp://likitoriya.com/goods/iclusig.html йкоза и острого лимфобластного лейкоза.
ПрименениеРекомендуемая доза и график Iclusig составляет 45 мг перорально один раз в день. Продолжать лечение до тех пор, пока пациент не свидетельствует прогрессирования заболевhttp://likitoriya.com/goods/iclusig.html ания или неприемлемой токсичности Iclusig может быть использован с или без пищи Iclusig таблетки следует проглатывать целиком, и не должен быть измельчен или растворен
Москва, Санкт-Петербург, Екатеринбург, Казань, Саратов, Пермь, Воронеж, Красноярск, Уфа, Омск, Волгоград, Барнаул, Хабаровск, Иркутск, Калининград, Владивосток, Тула, Тюмень, Ижевск, Томск, Пенза, Оренбург, Ульяновск, Йошкар-Ола, Тольятти, Кемерово, Ярославль, Рязань, Ставрополь, Липетск, Мурманск, Курск, Сургут, Смоленск, Абакан, Новокузнецк, Орел, Калуга, Магнитогорск, Сочи, Киров, Кострома, Астрахань, Пятигорск. Перечень постоянно дополняется, спрашивайте консультанта, если Вашего города нет в списке
Смотрите также аналоги:Известных аналогов нет
Каталог лекарств
Скоро в продаже появится новое лекарственное средство для пациентов с хроническим миелоидным лейкозом (ХМЛ), для которых в настоящее время не существует альтернативных лекарственных препаратов после прохождения первичного и вторичного курса медикаментозного лечения, не оказавшего должного эффекта, или же вследствие того, что их раковые клетки мутировали и стали изначально устойчивыми к лечению, о чем рассказали исследователи на 52-ой ежегодной встрече американского общества гематологов.
В ходе I стадии клинических испытаний лекарственный препарат понатиниб (ponatinib) произвел значительный или полный гематологический эффект (отсутствие клеток ХМЛ в крови), а также цитогенетический эффект (отсутствие клеток лейкоза в костном мозге) у двух групп пациентов:
У пациентов, которые ранее принимали два или три кардинально новых препаратов для лечении ХМЛ – иматиниб/Гливек (imatinib/Gleevec), нилотиниб/Тасигна (nilotinib/Tasigna) и дазатиниб/Спрайсел (dasatinib/Sprycel) - и имеют к ним устойчивость.
И у пациентов, клетки лейкоза которых содержат мутационный T315I, устойчивый ко всем современным методам лечения.
Похоже, что понатиниб займет пустую нишу и станет спасением для тех пациентов, для которых в настоящее время не существует эффективных лекарственных препаратов,» говорит доктор медицины Хорхе Кортес, профессор в Отделении лейкозов Онкологического центра имени Андерсона при Техасском университете, представивший результаты исследования. «Мы питаем большие надежды после получения положительных результатов в ходе I стадии и уже приступили к основной II стадии клинических испытаний».
Доклиническое исследование показало, что понатиниб, разработанный компанией ARIAD Pharmaceuticals, полностью ингибирует мутацию, которая является причиной устойчивости к препаратам, подавляющим белок BCR-ABL, провоцирующий ХМЛ. BCR-ABL произведен с помощью измененного гена bcr-abl, который образуется, если две хромосомы обмениваются участками своих ДНК из отдельных генов bcr и abl. Такая аномальная хромосома называется филадельфийской.
К июлю 2010 года 67 пациентов дали согласие на участие в исследовании: 57 с ХМЛ, в том числе 42 на ранней или хронической стадии, 7 с быстропрогрессирующей формой и 8 в стадии, когда в крови появляются бластные клетки, то есть самой тяжелой стадии заболевания. У троих пациентов был острый лимфобластный лейкоз с филадельфийскими хромосомами, еще у троих острый миелоидный лейкоз, и у четырех были остальные злокачественные болезни крови.
В общей сложности было рассмотрено 48 пациентов к моменту представления исследования. Из них:
У 30 из 32 пациентов (94 %) с хронической степенью ХМЛ наблюдался полный гематологический эффект; у 20 (63 %) наблюдался значительный цитологический эффект, у 12 полный и у 8 частичный. Из этих 20 испытуемых с цитогенетическим эффектом, 18 продолжили лечение без прогрессирования заболевания.
У всех 11 пациентов с ХМЛ в хронической стадии, у которых была мутация T315I, наблюдался полный гематологический эффект, и у 9 значительный цитогенетический эффект, при чем у 8 из них эффект был полный.
Из 16 пациентов в ХМЛ с быстропрогрессирующей формой, стадией развития бластных клеток или острым лимфобластным лейкозом с филадельфийскими хромосомами, у 5 (31 %) наблюдался значительный гематологический эффект, и у 3 (19 %) значительный цитогенетический эффект.
Из 9 пациентов с ХМЛ с быстропрогрессирующей формой, стадией развития бластных клеток или острым лимфобластным лейкозом с филадельфийскими хромосомами, которые имели мутированный T315I, у 3 (33 %) наблюдался значительный гематологический эффект, и у 2 (22 %) значительный цитогенетический эффект.
Исследователи также отметили эффект у больных с высокой устойчивостью заболевания к лекарствам, без каких-либо мутаций, а также у пациентов с мутациями, устойчивыми к существующим препаратам.
Самыми распространенными побочными эффектами были: снижение количества тромбоцитов (24 % пациентов), головная боль (14 %), тошнота (14 %), боль в суставах (13 %), слабость (13 %), анемия (11 %), увеличение липазы в крови (11 %), спазмы мышц (11 %), сыпь (11 %), боль в мышцах (10 %) и панкреатит (10 %). Дозолимитирующая токсичность была обратима.
 Понатиниб (англ. ponatinib ) — международное непатентованное наименование (МНН) нового лекарственного препарата, предназначенного для лечения пациентов с для лечения резистентного хронического миелобластного лейкоза и острого лимфобластного лейкоза с филадельфийской хромосомой.
Понатиниб (англ. ponatinib ) — международное непатентованное наименование (МНН) нового лекарственного препарата, предназначенного для лечения пациентов с для лечения резистентного хронического миелобластного лейкоза и острого лимфобластного лейкоза с филадельфийской хромосомой.
В 2014 году ВОЗ включил понатиниб в АТХ. в группу «L01 Противоопухолевые препараты », подгруппу «L01XE Ингибиторы протеинкиназы» и ему присвоен код — L01XE24.
Понатиниб разрешён к применению в США и странах Евросоюза. Однако во второй половине 2013 года продажи понатиниба по просьбе FDA были приостановлены и возобновлены 20.12.2013 после коррекции информации о показаниях и противопоказаниях препарата. В России разрешение на применение на имеет.
Торговое наименование лекарства с действующим веществом понатиниб — Iclusig™ (Иклусиг).
Категория риска FDA для плода при приёме понатиниба беременной — D (получены доказательства риска неблагоприятного действия лекарственного средства на плод человека, однако потенциальная польза, связанная с применением лекарственного средства у беременных, может оправдывать его использование, несмотря на риск).
Понатиниб (Iclusig) — рецептурный (Rx ) препарат. Фирма-изготовитель (дистрибьютор) — Ariad Pharmaceuticals (США).
Инструкции по применению понатиниба (pdf, на английском):
Долгие годы ученые изучают природу развития злокачественных новообразований и методы борьбы сними. Прогресс в молекулярной биологии открыл возможности для развития еще неизвестных подходов к лечению больных онкологическими заболеваниями. Благодаря этому были разработаны препараты, некоторые из которых могут стать принципиально новым оружием в борьбе с раком, среди них - специфические антитела и вирусы, разрушающие раковые клетки.
В этой статье будут представлены лекарственные средства, выбирая которые мы основывались на новинках в разработках и технологиях препаратов против рака. На данный момент они находятся на финальных стадиях клинических исследований. Эти лекарственные средства, безусловно, вызывают огромный интерес у инвесторов, медицинского сообщества и человечества в целом.
Внимание! Большинство из этих препаратов доступны для участников медицинских экспериментов, проходящих в Израиле. В данных программах участвуют все крупные Университетские Медицинские Центры Израиля. Ниже представлен список противоопухолевых препаратов, представляющих, по мнению экспертов, наибольший интерес.
Этот препарат предназначен для лечения множественной миеломы - второго по распространенности вида рака среди других лейкозов, образующегося в результате аномалии клеток плазмы, как правило, в костном мозгу. По оценкам Европейской сети организаций, регистрирующих случаи онкологических заболеваний (European Network of Cancer Registries), ежегодно в Европе фиксируется 21420 новых случаев множественной миеломы, а умирают от этого заболевания 15тыс. чел. в год.
Пооценкам Международного союза против рака (International Union Against Cancer), в настоящее время в Европе живет 60тыс. больных миеломой. Несмотря на то что в продуктовом портфеле "Onyx Pharmaceuticals Inc.” есть лекарственное средство для лечения рака почек и печени Nexavar/Нексавар (сорафениб), компания возлагает огромные надежды на ингибитор протеасом карфилзомиб.
"Pfizer Inc.” вскором будущем планирует подать заявку на одобрение FDA своего многообещающего лекарственного средства от немелкоклеточного рака легкого - кризотиниба. Компания делает акцент на развитие рыночной ниши в лечении редких заболеваний, поскольку этот препарат рассчитан на терапию непосредственно пациентов, страдающих немелкоклеточным раком легког о, у которых происходит слияние 2генов - ALK иEML4,- результатом чего является избыточная продукция фермента, ведущего к усилению роста раковых клеток. Кризотиниб взаимодействует с данным ферментом, подавляя его активность, что приводит к ликвидации раковых клеток.
В 2010г. "Pfizer” предоставила подробную информацию о ранних результатах клинических исследований этого препарата. В пилотном исследовании ALK-ингибитора приняли участие 82 пациента. Кризотиниб способствовал уменьшению размеров опухолей у 57% больных и остановил прогрессирование заболевания у 87%. Положительное действие сохранялось в течение года.
Клинические исследования, в которых были задействованы 104 пациента, показали, что висмодегиб уменьшает размер опухоли, в том числе у больных местно-распространенной или метастатической формой. Базально-клеточная карцинома является наиболее распространенным видом рака кожи в Европе, Австралии и США. В мире ежегодная заболеваемость этой патологией составляет около 2 млн случаев.
Известный под кодом GDC-0449, препарат получил утвержденное ВОЗ международное непатентованное название- висмодегиб. Это низкомолекулярный ингибитор Hh (hedgehog) сигнального пути для применения в качестве монотерапии у пациентов с метастазирующей или местно-распространенной базально-клеточной карциномой. Ген Hedgehog (Hh) был открыт лауреатами Нобелевской премии К. Нюсслайн-Вольхард и Э. Вейссхаузом в1980 г. в клетках плодовой мушки D. melanogaster. Сигнальный путь, который активируется Hh и имеет аналогичное название, играет важную роль в процессах эмбрионального развития организма и может вызывать неконтролируемый рост клеток, характерный для рака.
Американская биотехнологическая компания "Amgen Inc.”, приобретшая частную биотехнологическую компанию "BioVex Group Inc.”, возлагает большие надежды на разработанную ею противоопухолевую вакцину OncoVex. Потенциально успешный препарат компании получен из модифицированного вируса герпеса. разработанного для репликации внутри опухолевой ткани,- вирус проходит через нее и уничтожает опухоль помере ее развития. Вакцина предназначена для профилактики и лечения метастатической меланомы.
OncoVex превращает погибшие раковые клетки в белок (GMCSF), благотворно влияющий на состояние иммунной системы человека (Liu T.C. Galanis E. Kirn D. 2008). Во II фазе клинических исследований эффективность препарата отмечалась у 26% больных меланомой (самой злокачественной и крайне тяжело поддающейся лечению формой рака кожи) даже при инъекции в отдаленные от очага развития опухоли участки, что говорит о системной активности разрабатываемого лекарственного средства. Также, как сообщила компания-производитель, результаты II фазы клинических исследований показали, что из 13 пациентов, не имевших ответа на другие виды лечения, у 7 было достигнуто излечение рака кожи - меланомы.
В настоящее время вакцина находится в III фазе клинических исследований. Кроме этого показания, препарат исследуется для лечения раковых образований головы и шеи, молочной и поджелудочной железы (www.clinicaltrials.gov).
Швейцарская фармацевтическая компания "Roche” совместно с американской биотехнологической компанией "Plexxikon Inc.”, которую в текущем году приобрела японская фармацевтическая компания "Daiichi Sankyo Co. Ltd.” за 935 млн дол. США, подали заявку в FDA и Европейское агентство по лекарственным средствам (European Medicines Agency) на одобрение экспериментального препарата вемурафениб (PLX4032/RG7204) для лечения наиболее агрессивных форм рака кожи.
В августе 2010г. были опубликованы результаты I фазы клинических исследований, показавшие, что у 81% больных меланомой размеры опухоли сократились минимум на 30%.
Вемурафениб - это инновационное лекарственное средство, селективно блокирующее мутированный BRAF-белок, вызывающий рак. Этот белок является важным медиатором клеточного роста и деления. Его мутация обнаруживается у 60% пациентов с меланомой и у 8% больных другими типами солидных опухолей. Действие вемурафениба направлено на связывание с клетками, несущими мутацию BRAF. и впоследствии их разрушение. В итоге новое лекарство помогает не только уменьшить опухоль, но и остановить ее распространение. А это очень важно, поскольку в настоящее время менее 5% пациентов живут более 2 лет в случае распространения рака на большую часть кожи. Также компания "Roche” разрабатывает специальные тесты для диагностики мутации BRAF-белка.
Препарат понатиниб разработан "Ariad Pharmaceuticals Inc.” так, чтобы полностью ингибировать мутантный белок BCR-ABL (втом числе T315I), являющийся ключевым патогенетическим фактором развития хронического миелоидного лейкоза. Данный белок экспрессируется с помощью измененного гена bcr-abl, образующегося приобмене участками ДНК между собой изотдельных генов bcr иabl между 2хромосомами. Результатом этого является образование аномальной хромосомы (филадельфийской).
Вдекабре 2010г. компания сообщила, что входе клинических исследований у66% больных, получавших препарат, отмечался значительный цитологический эффект (отсутствие клеток лейкоза вкостном мозге). Упациентов смутацией T315I, устойчивой ковсем современным методам лечения, ответ был в100% случаев (Tianjun Zhou, Lois Commodore, 2011). Исследователи также отметили эффект убольных свысокой устойчивостью заболевания клекарствам, без каких-либо мутаций.
Внастоящее время понатиниб находится вII фазе клинических исследований поповоду лечения пациентов схроническим миелоидным лейкозом.
C 1977 г. новых препаратов, одобренных для лечения лимфомы Ходжкина. не было. Пока не разработан метод терапии пациентов, являющихся резистентными или рецидивирующими после аутологичной пересадки стволовых клеток. Возможно, в связи с этим 14июля 2011г. консультативная комиссия FDA проголосовала за рекомендацию ускоренного одобрения лекарственного средства брентуксимаб ведотин компании "Seattle Genetics Inc.” для лечения больных, страдающих лимфомой Ходжкина и прошедших трансплантацию стволовых клеток, а также для пациентов с рецидивирующей системной анапластической крупноклеточной лимфомой (ALCL).
Во II фазе клинического исследования данного препарата приняли участие 102 пациента, у которых аутогенная трансплантация стволовых клеток не дала результатов. Исследования показали, что при приеме брентуксимаба у 34% больных отмечалась полная ремиссия, у 40%- частичная. В целом у 94% пациентов выявили, по крайней мере, некоторое сокращение размеров опухоли.
Лекарственное средство также изучается по поводу терапии рецидивирующей или резистентной системной анапластической крупноклеточной лимфомы. В исследованиях у 57% больных отмечалась полная ремиссия. средняя продолжительность которой составляла 13,2 мес. В случае если препарат будет одобрен в США и Канаде, его маркетингом займется "Seattle Genetics”, а на остальных рынках- "Takeda Pharmaceutical Company Limited”.
Многообещающие разработки маленьких компаний привлекают инвестиции или становятся причиной их покупки. Так, японский концерн "Astellas Pharma Inc.” приобрел права за 1,3 млрд дол. на совместную разработку с американской компанией "Aveo Pharmaceuticals Inc.” экспериментального лекарства против рака - тивозаниба - и маркетирование его на рынке. В настоящее время тивозани б находится на финальной стадии клинических исследований по поводу лечения почечной карциномы. Пациенты, принимающие лекарственное средство, в среднем жили без ухудшения состояния 11,8мес.
Европейские регуляторные органы присвоили тивозанибу статус орфанного препарата для лечения рака почек. В случае одобрения лекарство получит эксклюзивное право на маркетинговое продвижение сроком на 10 лет на территории Европы.
"Roche”- один из лидеров в разработке противораковых лекарственных средств. Новым препаратом, который может пополнить продуктовый портфель компании, является трастузумаб эмтансин (международное не патентованное название T-DM1) для применения при HER2 позитивном метастатическом раке молочной железы. В рамках II фазы клинического исследования с участием 137 пациентов, опубликованного в октябре 2010г. проводилось сравнение монотерапии трастузумабом эмтансином с лечением препаратом Herceptin/Герцептин (трастузумаб) в сочетании с химиотерапией доцетакселом в качестве терапии первой линии. У47,8% пациентов отмечался ответ на лечение T-DM1 по сравнению с 41,4% больных, принимавших Герцептин совместно с химиотерапией.
Также у пациентов, получавших трастузумаб. выявили достоверное увеличение выживаемости без прогрессирования заболевания при меньшей частоте побочных эффектов, типичных для химиотерапии. Имея отличные результаты во II фазе клинических исследований T-DM1, компания "Roche” подала заявку наодобрение вFDA, которую вавгусте 2010г. отклонили. Официальной причиной назвали желание регуляторных органов увидеть окончательные результаты крупных исследований.
Трастузумаб эмтансин является комбинацией Herceptin/Герцептин (трастузумаб) и химиопрепарата DM1 ("ImmunoGen Inc.”), первым в своем роде лекарством, в состав которого входят конъюгированные моноклональные антитела и химиотерапевтическое средство. Это обеспечивает доставку мощного цитотоксического средства непосредственно к опухоли, введение которого в организм иным способом невозможно.
Имеющийся в наличии арсенал лекарственных средств для химиотерапии рака простаты. который, ксожалению, очень часто диагностируют на стадии метастазирования, скоро может пополнить препарат кабозантиниб. разработанный учеными американской фармацевтической компании "Exelixis Inc.”.
Кабозантиниб является пероральным ингибитором сосудистого эндотелиального фактора роста 2 (VEGFR2). Пациенты с различными распространенными раковыми новообразованиями хорошо отвечали на лечение этим лекарственным средством. Особенно отличные результаты отмечались при раке предстательной железы, яичников и печени.
Новый препарат, ингибирующий 2 пути роста опухоли, также показал активность в отношении костных метастазов. Лечение кабозантинибом полностью или частично устраняло костные метастазы у больных раком молочной железы, предстательной железы и меланомой. В целом у 59 из 68 пациентов с костными метастазами отмечался ответ на лечение. Частичное или полное исчезновение костных метастазов сопровождалось облегчением боли и уменьшением потребности в лекарствах.
Несмотря на такой прогресс и возможные перспективы, рак все равно остается одним из самых опасных заболеваний. Будем надеяться, что усилия фарминдустрии дадут свои ошеломляющие результаты и в недалеком будущем смертельную болезнь удастся полностью победить.
Прайс на лечение в ИзраилеОтправьте ваши выписки на имейл info@is-med.com и получите персональную программу лечения в Израиле с расценками частной и государственной клиники, либо оставьте ваши контактные данные и мы перезвоним вам.
Выбор - за вами! Мы просто хотим вам помочь!
Дайджест / Новые лекарства, формы и показания » Препарат Иклусиг (понатиниб) для лечения редких форм лейкемии одобрен в США

FDA одобрило препарат Иклусиг/Iclusig (понатиниб/ponatinib) производства ARIAD Pharmaceuticals. Лекарственное средство предназначено для лечения взрослых пациентов, у которых были диагностированы редкие заболевания крови и костного мозга, а именно хронический миелолейкоз (ХМЛ) и острый лимфобластный лейкоз с положительной филадельфийской хромосомой (Ph+ ОЛЛ).
Принцип действия Иклусига (понатиниба) основан на блокировании ряда белков, участвующих в развитии раковых клеток. Пациенты с хроническим миелолейкозом или острым лимфобластным лейкозом с Ph+ в хронической фазе, фазе акселерации или бластного криза должны принимать препарат один раз в день, если у них была зафиксирована устойчивость или непереносимость ингибиторов тирозинкиназы. Понатиниб оказывает действие на клетки ХМЛ с особой мутацией Т315I. Особое изменение генотипа приводит к развитию устойчивости этих клеток к утвержденным ингибиторам тирозинкиназы.
Эффективность препарата Иклусиг (понатиниб) подтверждена результатами клинических исследований, в которых приняло участие 449 пациентов с различными фазами ХМЛ и Ph+ ОЛЛ. В ходе исследования оценивалось снижение доли клеток, экспрессирующих филадельфийскую хромосому. Большой цитогенетический ответ (БЦО) был достигнут у 54% всех пациентов и у 70% больных с мутацией Т315I. Исследователи отметили, что не была достигнута медиана продолжительности цитогенетического ответа.
Эффективность понатиниба у пациентов с хроническим миелолейкозом или острым лимфобластным лейкозом с положительной филадельфийской хромосомой в ускоренной фазе и фазе бластного криза определялась по количеству пациентов, у которых нормализовался уровень белых кровяных телец или отсутствовали признаки лейкемии. Большой цитогенетический ответ был достигнут у 52% пациентов с медианой времени достижения 9,5 месяца, у 31% пациентов с ХМЛ в фазе бластного криза с медианой достижения 4,7 месяца и у 41% пациентов с Ph + ОЛЛ с медианой времени достижения 3,2 месяца.
Наиболее распространенные побочные эффекты, связанные с приемом препарата Иклусиг (понатиниб), это высокое кровяное давление, головная боль, тошнота, боль в животе, сыпь, запоры, боль в суставах, повышение температуры тела. Производитель предупреждает, что препарат обладает гепатотоксичностью, а также его применение может привести к повышенному риску развития тромбоза.
Остановлена продажа лекарственного препарата для лечения рака

Американская фармацевтическая компания ARIAD Pharmaceuticals прекратила клинические исследования и приостановила продажу противоопухолевого препарата Иклусиг из-за развития у 11,8% пациентов серьезных тромбозов, которые привели к инсульту, ишемической болезни сердца, сердечной недостаточности и даже к летальным исходам.
ARIAD Pharmaceuticals приостановила продажу лекарственного препарата Иклусиг/ понатиниб (Iclusig/ ponatinib), предназначенного для лечения таких заболеваний как хронического миелолейкоза (ХМЛ) и острого лимфобластного лейкоза с положительной филадельфийской хромосомой (Ph+ ОЛЛ), а также метастатических и/или нерезектабельных гастроинтестинальных стромальных опухолей (gastrointestinal stromal tumors, GIST) у пациентов, которым не помогла предыдущая терапия. Ранее в октябре месяце текущего года, по распоряжению Администрации по контролю за продуктами и лекарствами США (FDA) были приостановлены клинические испытания этого препарата после обнаружения угрозы Иклусига для здоровья пациентов. В инструкции по применению препарата было размещено информация о том, что препарат способен вызывать тромбозы и обладает гепатотоксичностью.
Иклусиг (понатиниб) получил ускоренное одобрение FDA в декабре прошлого года, а в июне 2013 года сообщалось о начале клинического испытания II Фазы этого препарата. Это клиническое испытание являлось открытым, многоцентровым исследованием, разработанным для оценки эффективности и безопасности препарата Понатиниб у пациентов с GIST, которым не помогла предыдущая терапия. При этом, пациенты, принимающие участие в исследовании, были разделены на две группы. Те пациенты, в опухолях которых наблюдались мутации в экзоне 11 онкогена KIT, входили в группу A, а те, кто имели другие активные мутации – в группу B.
Испытание проходило в трех исследовательских центрах в США: Онкологическом Институте Дана Фарбера (Dana Farber Cancer Institute), Онкологическом центре Фокс Чейза (Fox Chase Cancer Center) и Орегонском университете медицины и науки (Oregon Health Science University). В исследовании приняли участие более 45 пациентов, 30 из которых с мутациями в онкогене KIT. Пациенты получали одинаковые дозы понатиниба – 45мг для приема раз в день перорально, как и пациенты, страдающие лимфобластным лейкозом с положительной филадельфийской хромосомой.
Исследование показало, что 24% пациентов, принимающих понатиниб, перенесли в ходе лечения инфаркт, инсульт или другие серьезные сосудистые осложнения. У 67% участников было отмечено высокое давление. а у 8% развилась сердечная недостаточность, в том числе приведшая к летальному исходу. Администрации по контролю за продуктами и лекарствами США заявило, что на настоящий момент не может определить в какой дозировке Понатиниб безопасен для пациентов, и как долго можно принимать препарат.