







 Рейтинг: 4.9/5.0 (1575 проголосовавших)
Рейтинг: 4.9/5.0 (1575 проголосовавших)Категория: Инструкции
Римадил, кто-нибудь лечил им кошек? опыт нужен
Добрый день, я уже тут месяц назад писала про своего вдруг захромавшего котейку, который хромал даже непонятно на какую лапу. Потом поняли - левая передняя. при этом он все так же носился как электровеник. Предположили, что спрыгнул неудачно, позвонили своему вету, сказал понаблюдать. Все и правда за неделю прошло. Потом мы были 2 недели в отпуске, те, кто к нему без нас приходил, никакой хроматы не замечал. да и кот, когда они больше спит, мало ходит. Приехали, два дня все было нормально и тут в понедельник снова захромал. ПОехали к вету - при нем он хромать отказался, как впрочем и ходить, только прополз на брюхе. Все ощупали, сделали укол метакама и дали три таблетки римадила - все это нестероидные противовоспалительные. Таблетки давать раз в 48 часов и потом посмотреть, если хромота останется или появится снова, тогда уже рентген, анализы и проч. И вот я начиталась дома про римадил, ну во-первых, он для собак, во-вторых, отзывы о нем от восторженных, до прямо противоположных - убивает он животных. И доза у нас какая-то странная, раз в 48 часов. Что делать, ума не приложу. не доверять доктору оснований нет, он нам уже спасал кота. Да и клиника специализируется на ортопедии как раз. но и мнительность свою не могу перебороть. Кто-нибудь слышал про это лекарство применительно к кошкам?
Последний раз редактировалось gaffsa; 07.08.2008 в 15:33.
Сообщение от gaffsa
если хромота останется или появится снова, тогда уже рентген, анализы и проч.
а ЧЕ доктору ленностно сразу обследовать котейку? нужно замазать клинику чтоли? а если препарат окажет временное облегчение, а так оно и будет, ведь он обладает анальгетическим действием. сама причина может быть не устанена и время потеряно. можно конечно было назначить противоспалительные препараты, но одновременно с обследованием. Римадил ветеринарный препарат для собак и лошадей, почему бы не назначить например Кетофен или Аубикал.
__________________
Прежде чем осуждать кого-то возьми его обувь и пройди его путь, попробуй его слезы, почувствуй его боли, наткнись на каждый камень, о который он споткнулся. И только после этого говори, что ты знаешь- как правильно жить.
Последний раз редактировалось Хозяйка Бриллианта; 07.08.2008 в 21:47.
Rimadyl palatable tablets
Состав и форма выпускаРимадил Р таблетки со вкусом печени – светло-коричневые таблетки с вытисненной буквой «R» с одной стороны таблетки и разделительной бороздкой на другой стороне, содержащие в качестве действующего вещества 20, 50 или 100 мг карпрофена и вспомогательные компоненты: высушенный распылением порошок свиной печени, гидролизированный растительный белок, кукурузный крахмал, кондитерский сахар, глюкозный сироп, желатин (тип А), магния стеарат и лактозы моногидрат. Расфасовывают в пластиковые банки по 20, 30, 50, 60, 100 и 180 таблеток.
Фармакологические свойстваРимадил Р, относящийся к группе нестероидных противовоспалительных препаратов, обладает противовоспалительным, анальгетическим и жаропонижающим действием. Карпрофен, действующее вещество Римадила Р, в цикле арахидоновой кислоты преимущественно ингибирует циклоксигеназу-II, которая вырабатывается в организме в ответ на развитие воспаления. В результате блокируется синтез воспалительных простагландинов, вызывающих воспаление, отек и боль. В терапевтических дозах карпрофен значительно слабее действует на циклоксигеназу-I, и благодаря этому не оказывает влияния на синтез протективных простагландинов. Карпрофен не препятствует нормальным физиологическим процессам в тканях, особенно в желудке, кишечнике, почках и тромбоцитах, быстро всасывается из желудочно-кишечного тракта, достигает пика концентрации в плазме крови через 1 – 3 часа после введения, при биодоступности более 90%. Время полувыведения у собак составляет около 8 часов. Карпрофен более чем на 99% связывается с белками плазмы крови. Метаболизируется препарат в печени, выделяется с фекалиями (около 80%), а также с мочой.
ПоказанияНазначают собакам для облегчения воспалительных и болевых явлений при острых и хронических заболеваниях опорно-двигательного аппарата (остеоартриты), для анальгезии и в качестве противовоспалительного средства для уменьшения послеоперационных болей и отеков.
Дозы и способ примененияРимадил таблетки со вкусом печени применяют только внутрь. В начале лечения суточная доза составляет 4 мг карпрофена на 1 кг массы тела (например, 1 таблетка Римадила Р, содержащая 20 мг карпрофена, на 5 кг веса животного, 1 таблетка Римадила Р, содержащая 50 мг карпрофена, на 12,5 кг веса животного или 1 таблетка Римадила Р, содержащая 100 мг карпрофена, на 25 кг веса животного). Рекомендуется распределить суточную дозу на две равные части. После 7 дней лечения в зависимости от клинических показаний суточную дозу можно уменьшить до 2 мг/кг массы тела в день (1 таблетка 20 мг на 10 кг, 1 таблетка 50 мг на 25 кг или 1 таблетка 100 мг на 50 кг веса животного) на 1 введение. Длительность терапии зависит от состояния животного, но после 14 дней лечения животное должно быть снова осмотрено ветеринарным врачом.
Побочные действияВ редких случаях может возникнуть раздражение слизистой оболочки желудка и рвота.
ПротивопоказанияГиперчувствительность к карпрофену. Не применять щенным сукам. Препарат следует назначать с осторожностью животным с заболеваниями сердца, почек и печени. Не рекомендуется назначать другие нестероидные противовоспалительные средства или нефротоксичные препараты ранее, чем через 24 часа после введения Римадила Р.
Особые указанияНе превышать установленную дозу или продолжительность лечения. При одновременном использовании карпрофена и варфарина необходимо тщательно контролировать клиническую ситуацию, поскольку оба этих препарата связываются с белками плазмы крови. Во время процедуры с Римадилом Р следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными средствами. Как и при применении любых других лекарственных средств, после работы следует тщательно вымыть руки теплой водой с мылом. Запрещается во время работы принимать пищу и воду.
Условия храненияС предосторожностью (список Б) в сухом, темном, недоступном для детей месте при температуре от 0 до 25 °С. Срок годности – 3 года.

Медициское средство римадил является противовоспалительным, жаропонижающим и анальгетическим препаратом. В состав лекарства входит вещество – карпрофен и различные вспомогательные вещества.
Данный препарат назначают при заболеваниях опорно – двигательного аппарата, анальгезии, также римадил применяют с целью уменьшения болей в послеоперационном периоде у животных.
Лекарство для внутреннего применения. При лечении в сутки следует принимать четыре миллиграмма римадила на один килограмм массы животного. После семидневного приема доза лекарства понижается до двух миллиграмм на один килограмм массы животного. Прием длится еще одну неделю. После чего следует снова показаться ветеринарному врачу.
Запрещено применять препарат животным, которые недавно принесли потомство. Также не желательно давать препарат животным с болезнями почек, печени и сердца.
Лекарственный препарат при правильном применении и соблюдении рекомендаций не вызывает никаких побочных эффектов.
Оставить комментарийКомментарии (страница %page%)
![]()
Гость (23 Декабря, 2013, 17:04):
Нам выписали, при хромоте, но боимся покупать, тк прочла в статье что есть побочное действие смерть животного. Вот ссылка на статью http://www.chow.ru/vp/health/dis/oda/rimadyl.html Читаю наши инструкции к препарату там не указанно данное побочное действие смерть животного. В растерянности, боимся давать. Ответить
![]()
Гость (04 Декабря, 2013, 09:15):
Моей кошечке очень помог это припарат. У нее было защемления позвонка,начала хромать,лечили 14 дней.Теперь вот носится как лошадь. Ответить
![]()
Подходит индивидуально. Побочные симптомы так же развиваются далеко не у всех пациентов. Длительный курс лучше проводить в сочетании с препаратами снижающими секрецию желудочного сока. Ответить

Римадил существует в нескольких разновидностях:
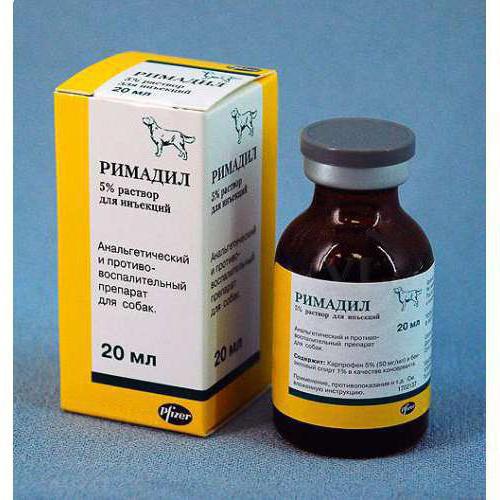
Римадил 5% раствор для инъекций - прозрачный раствор желтого цвета.
Римадил, таблетки 20 и 50 мг.
Римадил Р – таблетки с привлекательным для собак вкусом.
(20, 50 и 100 мг) – Rimadyl Palatable Tablets 20, 50 and 100 mg
Фармакологические свойства
Карпрофен, действующее вещество Римадила, относится к группе нестероидных противовоспалительных препаратов, и обладает противовоспалительным, анальгетическим и жаропонижающим действием.
Карпрофен, как и другие нестероидные противовоспалительные препараты, ингибирует циклоксигеназу в цикле арахидоновой кислоты. При этом препарат преимущественно влияет на циклоксигеназу-II, которая индуцируется в ответ на развитие воспаления. В результате блокируется синтез воспалительных простагландинов, вызывающих воспаление, отек и боль.
В терапевтических дозах карпрофен значительно слабее действует на циклоксигеназу-I, и благодаря этому не оказывает влияния на синтез протективных простагландинов. Таким образом, карпрофен не препятствует нормальным физиологическим процессам в тканях, особенно в желудке, кишечнике, почках и тромбоцитах.
Порядок применения
Римадил 5% раствор для инъекций применяют для снятия болевых и воспалительных реакций у собак после оперативных вмешательств. Препарат применяют внутривенно или подкожно в дозе 4,0 мг/кг карпрофена (или 1 мл раствора на 12,5 кг живой массы). Рекомендуется вводить Римадил во время премедикации или при проведении анестезии.
Римадил таблетки назначают при воспалительных и болевых явлений при острых и хронических заболеваниях опорно -двигательного аппарата. Римадил таблетки также применяют для анальгезии и в качестве противовоспалительного средства для уменьшения послеоперационных болей и отеков у собак. Препарат назначают внутрь. В начальный период лечения суточная доза составляет 4 мг карпрофена на 1 кг массы тела. Рекомендуется распределить суточную дозу на две равные части. После 7 дней лечения в зависимости от клинических показаний суточную дозу можно уменьшить до 2 мг/кг массы тела в день на 1 введение.
Состав
Римадил Р – нестероидное противовоспалительное лекарственное средство в форме таблеток для перорального применения, содержащих в качестве действующего средства карпрофен – 20 мг, 50 мг или 100 мг в таблетке, а в качестве вспомогательных веществ высушенный распылением порошок свиной печени, гидролизированный растительный белок, кукурузный крахмал, кондитерский сахар, глюкозный сироп, желатин тип А, магния стеарат, и лактозы моногидрат.
Лекарственная форма
По внешнему виду Римадил Р со вкусом печени представляет таблетки светло-коричневого цвета с вытисненной буквой “R” с одной стороны таблетки и разделительной бороздкой на другой стороне.
Упаковка, условия хранения, срок годности
Римадил Р таблетки со вкусом печени по 20, 30, 50, 60, 100 или180 таблеток упаковывают во флаконы квадратной формы из полиэтилена высокой плотности белого цвета с полипропиленовой крышкой, недоступной для открывания детьми. Каждый флакон на русском языке маркируют с указанием названия лекарственного средства, названия организации-производителя и ее адреса, наименования и содержания действующего вещества, назначения, условий хранения, номера серии, даты изготовления и срока годности, надписью «Для животных».
Хранят с предосторожностью (список Б), в сухом, темном и недоступном для детей месте при температуре от 0 до 25 ?С. Срок годности 3 года со дня изготовления при условии хранения в заводской упаковке. Не применять Римадил Р после истечения срока годности.
Фармакологические свойства
Карпрофен, действующее вещество Римадила Р, относится к группе нестероидных противовоспалительных препаратов, и обладает противовоспалительным, анальгетическим и жаропонижающим действием. Карпрофен, как и другие нестероидные противовоспалительные препараты, ингибирует циклоксигеназу в цикле арахидоновой кислоты. При этом препарат преимущественно влияет на циклоксигеназу-II, которая индуцируется в ответ на развитие воспаления. В результате блокируется синтез воспалительных простагландинов, вызывающих воспаление, отек и боль. В терапевтических дозах карпрофен значительно слабее действует на циклоксигеназу-I, и благодаря этому не оказывает влияния на синтез протективных простагландинов. Таким образом, карпрофен не препятствует нормальным физиологическим процессам в тканях, особенно в желудке, кишечнике, почках и тромбоцитах. Карпрофен быстро всасывается из желудочно-кишечного тракта, достигает пика концентрации в плазме крови через 1-3 часа после введения, при биодоступности более 90%. Время полувыведения у собак составляет около 8 часов. Карпрофен более чем на 99% связывается с белками плазмы. Метаболизируется препарат в печени, выделяется главным образом с фекалиями (около 80%), и с мочой. Порядок применения, показания, доза, возможные побочные явления, противопоказания: Римадил таблетки со вкусом печени назначают при воспалительных и болевых явлениях, возникающих при острых и хронических заболеваниях опорно-двигательного аппарата. Римадил таблетки также применяют для анальгезии и в качестве противовоспалительного средства для уменьшения послеоперационных болей и отеков. Римадил таблетки со вкусом печени применяют перорально в начальный период лечения в суточной дозе 4 мг карпрофена на 1 кг массы тела. Рекомендуется разделить суточную дозу на две равные части. После 7 дней лечения в зависимости от клинических показаний суточную дозу можно уменьшить до 2 мг/кг массы тела.
При заболеваниях опорно-двигательного аппарата, продолжительность лечения зависит от состояния животного и под контролем ветеринарного врача может продолжаться в течение всей жизни животного. Не следует превышать установленную дозу. Как и при применении других нестероидных противовоспалительных препаратов после применения Римадила Р у отдельных животных, в редких случаях может возникать раздражение желудка и рвота. Запрещается применять Римадил щенным сукам.
Не назначать другие нестероидные противовоспалительные средства или нефротоксичные препараты ранее, чем через 24 часа после введения Римадила Р. Римадил Р, как и другие нестероидные противовоспалительные средства, следует назначать с осторожностью животным с заболеваниями сердца, почек и печени.
Меры личной профилактики
При работе с Римадилом Р следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными средствами. Как и при применении любых других лекарственных средств, после работы следует тщательно вымыть руки теплой водой с мылом. Запрещается во время работы принимать пищу и воду.
Регистрационный номер - ПВИ-2-7.6/02083
Превикокс (Previcox) 57 и 227 мг

Превикокс действует быстро, эффективно и безопасно. За счет высокоселективного действия на ЦОГ-2 Превикокс демонстрирует наиболее высокий уровень безопасности, что позволяет применять его в течение сверхдлительного времени без перерывов и снижения дозировки. Положительный эффект можно наблюдать уже спустя пару часов после первого приёма.
по применению Превикокс таблеток 57 мг и 227 мг собакам в качествепротивовоспалительно, болеутоляющего и жаропонижающего средства
(организация-разработчик: компания «Merial», Франция)
1.Торговое наименование лекарственного препарата: Превикокс таблетки 57 мг и 227 мг (Previcox 57 mgand227 mgtablets).
Международное непатентованное наименование: фирококсиб
2. Лекарственная форма: таблетки для орального применения
Препарат в качестве действующего вещества содержит фирококсиб - 24% (в зависимости от дозировки, соответственно 57 мг и 227 мг в таблетке); а также вспомогательные вещества: моногидрат лактозы - 49,3%, микрокристаллическую целлюлозу - 15%, гидроксипропилцеллюлозу - 3,0%, кроскарамеллозу - 2,8%; коллоидный диоксид кремния - 0,5%; вкусовые и ароматические вещества (ароматизатор со вкусом копченого мяса «ChartorHickorysmokeflavor» и карамель) - 5%; пигменты - желтый и красный оксиды железа - 0,4%. По внешнему виду препарат представляет собой таблетки коричневого цвета, округлой формы, выпуклые, гравированные, с риской.
3. Препарат выпускают расфасованным по 10 таблеток в блистеры, упакованные по 1, 3 или 18 штук в картонные коробки вместе с инструкцией по применению.
4. Хранят препарат в закрытой упаковке производителя, отдельно от продуктов питания и кормов, в сухом, защищенном от прямых солнечных лучей месте, при температуре от 0°С до 30°С.
Срок годности лекарственного препарата при соблюдении условий хранения - 3 года со дня производства. Неиспользованную половину таблетки допускается хранить в блистере не более 7 дней.
Запрещается применение Превикокс таблеток 57 мг и 227 мг по истечении срока годности.
5. Превикокс таблетки 57 мг и 227 мг следует хранить в недоступном для детей месте.
6. Неиспользованный лекарственный препарат утилизируют в соответствии с требованиями законодательства.
II. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
7. Превикокс таблетки 57 мг и 227 мг относятся к группе нестероидных противовоспалительных препаратов.
Фирококсиб, входящий в состав препарата, является селективным ингибитором циклооксигеназы-2 (СОХ-2), избирательно нарушает образование простагландинов, участвующих в формировании воспалительной реакции, подавляет экссудативную и пролиферативную фазы воспаления. Действует преимущественно в очаге воспаления и практически не влияет на продукцию простагландинов, регулирующих почечныйкровоток и целостность слизистой оболочки желудочно-кишечного тракта. Оказывает анальгезирующее, противовоспалительное и жаропонижающее действие.
После перорального введения собакам в рекомендованной дозе фирококсиб быстро всасывается, максимальная концентрация в крови достигается через 1,25 часа. Период полувыведения составляет 8 часов. Фирококсиб практически полностью связывается с белками крови, метаболизируется в печени, выводится с желчью через кишечник.
Превикокс таблетки 57 мг и 227 мг по степени воздействия на организм относятся к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007-76), в рекомендуемых дозах не оказывают сенсибилизирующего, тератогенного и эмбриотоксического действия.
III. ПОРЯДОК ПРИМЕНЕНИЯ
8. Превикокс таблетки 57 мг и 227 мг назначают собакам в качестве противовоспалительного, анальгезирующего и жаропонижающего средства при лечении остеоартрозов. а также после ортопедических операций и операций на мягких тканях.
9. Противопоказанием для применения является повышенная чувствительность животного к компонентам препарата (в том числе - в анамнезе).
Запрещается применять препарат беременным и лактирующим самкам, щенкам до 10-недельного возраста и собакам с массой менее 3 кг, а также животным с желудочно- кишечными кровотечениями, заболеваниями крови, при геморрагическом синдроме и тяжелой форме почечной и печеночной недостаточности.
10. Превикокс таблетки 57 мг и 227 мг применяют собакам индивидуально перорально один раз в сутки в дозе 5 мг фирококсиба на 1 кг массы животного, из расчета:

Превикокс таблетки 57 мг и 227 мг обладают привлекательным ароматом и вкусом, поэтому охотно поедаются собаками, в случае отказа от препарата его скармливают с кормом.
Продолжительность курса лечения при остеоартрозах зависит от состояния животного и определяется лечащим ветеринарным врачом. Применение препарата более 90 дней следует проводить под регулярным контролем ветеринарного врача.
Для облегчения послеоперационных болей препарат применяют за 2 часа до начала операции, а затем по необходимости 1 раз в день, в течение 3 суток,
11.При передозировке препарата у животного может наблюдаться избыточное слюноотделение, расстройство желудочно-кишечного тракта, угнетенное состояние.
12. Особенностей действия при первом применении препарата и при его отмене не выявлено.
13. При пропуске очередной дозы препарата его применение необходимо возобновить в предусмотренной дозировке и по той же схеме.
14. Побочных явлений и осложнений у животных при применении Превикокс таблеток 57 мг и 227 мг в соответствии с настоящей инструкцией, как правило, не наблюдается. У некоторых животных после применения препарата может возникать раздражение слизистой желудка, рвота и диарея, которые исчезают самопроизвольно и обычно не требуют дополнительного медицинского вмешательства. Если указанные симптомы не исчезают, в фекалиях появляется кровь, снижается масса животного, или у животного проявились аллергические реакции, применение препарата следует прекратить и обратиться к лечащему ветеринарному врачу.
15. Превикокс таблетки 57 мг и 227 мг не следует применять одновременно сдругими нестероидными противовоспалительными средствами и глюко кортикостероидами.
16.Превикокс таблетки 57 мг и 227 мг не предназначены для применения продуктивным животным.
IV. МЕРЫ ЛИЧНОЙ ПРОФИЛАКТИКИ
17.При работе с Превикокс таблетками 57 мг и 227 мг следует соблюдать общепринятые меры личной гигиены и техники безопасности, предусмотренные при работе с лекарственными средствами. Во время работы запрещается курить, пить и принимать пищу. После работы с лекарственным препаратом следует вымыть руки с мылом.
18. Людям с гиперчувствительностью к компонентам препарата следует избегать прямого контакта с Превикокс таблетками 57 мг и 227 мг. В случае появления аллергических реакций и/или при случайном попадании препарата внутрь необходимо обратиться в медицинское учреждение, имея при себе инструкцию по применению препарата или этикетку.
19.Блистеры и картонные коробки из-под препарата запрещается использовать для бытовых целей; их помещают в целлофановый пакет и утилизируют с бытовыми отходами
20. Организация-производитель: компания «Merial»; 29 av. Tony Garnier, 69007, Lyon, France. Адрес места производства Merial, 4 chemin du Calquet, 31057 Toulouse, France
Инструкция разработана компанией «Merial» 29 av. TonyGarnier, 69007, Lyon, Franceсовместно с Московским Представительством компании «Мериал С. А.С.». Москва
АТХ
M01AH01 Целекоксиб
Фармакологическая группа
•НПВС — Коксибы
Нозологическая классификация (МКБ-10)
•M06.9 Ревматоидный артрит неуточненный
•M15-M19 Артрозы
Состав и форма выпуска
1 капсула содержит целекоксиба 100 или 200 мг; в контурной ячейковой упаковке 10 шт. в картонной пачке 3 упаковки.
Фармакологическое действие
Фармакологическое действие - обезболивающее, противовоспалительное.
Селективно ингибирует циклооксигеназу-2 и блокирует образование провоспалительных ПГ (в частности простагландина Е2). В терапевтических дозах не влияет на активность циклооксигеназы-1 человека и таким образом не нарушает нормальные физиологические процессы, протекающие с участием простагландинов, в частности, в слизистой оболочке желудка, кишечника и тромбоцитах.
В контролируемых клинических исследованиях отмечалось, что частота осложнений со стороны ЖКТ не отличалась от плацебо и была достоверно ниже, чем при приеме неспецифических ингибиторов циклооксигеназы.
Показания препарата Коксиб
Деформирующий остеоартроз, ревматоидный артрит (симптоматическое лечение болевого и воспалительного синдрома).
Гиперчувствительность (в т.ч. к сульфаниламидам), аллергические реакции, связанные с приемом ацетилсалициловой кислоты и других НПВС, язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, I и III триместр беременности, грудное вскармливание.
Боль в животе, диарея, диспепсия, метеоризм, тошнота, головная боль, головокружение, бессонница, фарингит, ринит, синусит, анемия, периферический отек, судороги в ногах, аллергические реакции в виде кожной сыпи, зуда.
Антациды уменьшают всасывание из ЖКТ, флуконазол — концентрацию препарата в плазме.
Одновременное применение с варфарином увеличивает риск развития геморрагических осложнений.
Способ применения и дозы
Внутрь. При деформирующем остеоартрозе200 мг 1 раз в сутки или по 100 мг 2 раза в сутки; при необходимости — до 400 мг/сут в 2 приема; при ревматоидном артрите — 200–400 мг/сут в 2 приема.
Клинические данные по использованию препарата у пациентов с тяжелыми нарушениями функции печени и почек, а также у людей моложе 18 лет отсутствуют.
Условия хранения препарата Коксиб
В сухом, защищенном от света месте, при температуре не выше 25 °C.
Срок годности препарата Коксиб
2 года.

Селективные ингибиторы циклооксигеназы (ЦОГ) 2 – особая разновидность нестероидных противовоспалительных препаратов (НПВП), созданных для снижения риска развития «класс–специфических» гастроинтестинальных осложнений, столь характерных для этих лекарств. По своему фармакологическому профилю они не отличатся от «традиционных» НПВП и являются прежде всего средством для лечения боли и локального воспаления [1].
Важнейшей областью применения НПВП является ургентная аналгезия. Развитие острого болевого синдрома жестко связано с выбросом медиаторов боли, важнейшими среди которых являются простагландины (ПГ). Быстрое локальное повышение их концентрации в области тканевого повреждения или воспаления определяется работой фермента ЦОГ–2, обеспечивающего активный синтез предшественника простагландинов – ПГЕ2. Этот процесс и является основной фармакологической «мишенью» НПВП, которые по своей природе являются селективными или неселективными ингибиторами ЦОГ–2 [1–3].
Однако действие НПВП не исчерпывается лишь снижением активности периферических ноцицепторов. Не меньшее значение для развития обезболивающего эффекта НПВП может иметь их влияние на центральные механизмы передачи болевого импульса. Прохождение мощного афферентного болевого импульса и стойкая активация нейронов, расположенных в задних рогах спинного мозга, вызывают реакцию со стороны глиальных клеток, что сопровождается выбросом провоспалительных субстанций, и прежде всего ПГЕ2. Этот процесс, с которым связывают феномен «взвинчивания» (нарастающее повышение чувствительности спинальных нейронов), хорошо известен, как одно из важнейших звеньев патогенеза хронического болевого синдрома. Синтез ПГЕ2 является ЦОГ–2 зависимым процессом, а следовательно, подавляется НПВП [1–3].
В настоящее время имеются четкие лабораторные и клинические данные, показывающие, что НПВП – в частности, типичный представитель с–НПВП целекоксиб (Целебрекс) достаточно легко проникают в ткань ЦНС. Как показали исследования, проведенные с участием здоровых добровольцев, концентрация этих препаратов в цереброспинальной жидкости после перорального приема или парентерального введения близка соответствующей концентрации в плазме и вполне достаточна для развития фармакологического эффекта, связанного с подавлением активности ЦОГ–2 [4,5].
Подтверждением центрального действия НПВП являются экспериментальные данные, полученные Bianchi M. и сотр. Исследователи оценивали концентрацию ПГЕ2 и ФНО– α в ликворе крыс после периферической болевой стимуляции. Концентрация обеих субстанций при развитии боли резко возрастала: ПГЕ2 с 30 до 180 пг/мл и ФНО– α с 12 до 40 пг/мл. Однако если до появления боли животному вводился НПВП (в эксперименте был использован нимесулид) или парацетамол, концентрация ПГЕ2 не повышалась в сравнении с контролем; аналогичный эффект, правда, несколько менее выраженный, давал трамадол. В отношении ФНО– α ситуация была иной: лишь прием НПВП и комбинации парацетамол + трамадол снижали концентрацию этого вещества до уровня контроля; ни парацетамол, ни трамадол по отдельности такого эффекта не обеспечивали [6].
Таким образом, НПВП влияют как на периферические, так и на центральные механизмы появления и развития острой боли. Поэтому применение НПВП является патогенетической противоболевой терапией и должно рассматриваться, как необходимый компонент рациональной аналгезии при острых болевых синдромах в терапии, при травмах, а также после хирургических операций.
Патогенетическое влияние НПВП открывает уникальную возможность не только подавлять уже возникшую боль, но и проводить активную профилактику ее развития. НПВП эффективно используются до появления боли (в частности, назначение «нагрузочной» дозы препарата непосредственно перед операцией или болезненной диагностической процедуры носит название «предоперационной аналгезии»). Этот метод позволяет достичь значимого снижения интенсивности боли, развивающейся после повреждения ткани, и существенно снижать потребность в дополнительных анальгетиках.
Оценивая в целом применение этих препаратов в качестве ургентного обезболивающего средства, можно утверждать, что прием адекватной дозы НПВП в качестве монотерапии позволяет достичь приемлемого уровня аналгезии при умеренно выраженной острой боли, связанной с острой терапевтической патологией (например, при боли в нижней части спины, дисменорее, почечной колике и т.д.). Монотерапия НПВП вполне эффективна при минимальных хирургических вмешательствах (таких как удаление зуба), болезненных манипуляциях (репозиция перелома), особенно если эти препараты применяются в качестве «предоперационной аналгезии», а также при небольших травмах. При выраженной боли, связанной с серьезными хирургическими операциями или тяжелыми травмами, применение НПВП в программе комплексного обезболивания позволяет достичь лучших результатов аналгезии, обеспечивая большее снижение интенсивности боли и улучшение качества жизни, а главное – снижая потребность в наркотических анальгетиках на 20–30% («опиоид–сберегающее» действие) [1,7,8].
Селективные ингибиторы ЦОГ–2 широко используются в качестве средства для ургентного обезболивания. Тем не менее, до настоящего времени многие российские врачи придерживаются ошибочного мнения о том, что с–НПВП менее эффективны, чем «традиционные» представители этой лекарственной группы.
В качестве примера высокой терапевтической активности с–НПВП возможно рассмотреть опыт применения важнейшего представителя этого класса лекарственных препаратов – целекоксиба. На сегодняшний день целекоксиб среди всех с–НПВП имеет наибольшее число доказательств эффективности и относительной безопасности. Так, положение о значительно более низком (в сравнении с «традиционными» НПВП) риске развития гастроинтестинальных осложнений при использовании целекоксиба не вызывает сомнения. Это положение четко доказано серией длительных и масштабных рандомизированных контролируемых исследований (РКИ), данными эпидемиологического анализа и оценкой применения этого лекарства в реальной клинической практике [9–11].
В ходе большого числа исследований был получен обширный материал, подтверждающий высокую терапевтическую активность целекоксиба в качестве препарата для ургентного обезболивания.
Типичной «моделью» для оценки эффективности НПВП при острой боли, связанной с повреждением и воспалением ткани, является аналгезия после стоматологических операций. Так, Malmstrom K. и сотр. провели масштабное РКИ, в котором изучалась сравнительная эффективность однократного приема рофекоксиба 50 мг, целекоксиба 200 и 400 мг, ибупрофена 400 мг или плацебо у 482 больных, перенесших удаление как минимум 2 зубов (третьих маляров). Согласно полученным данным по основному критерию оценки – полному облегчению боли (TOTPAR) через 8 и 12 ч все три НПВП достоверно превосходили плацебо, причем целекоксиб в дозе 400 мг был близок по своей эффективности и рофекоксибу, и ибупрофену. В дозе 200 мг целекоксиб несколько уступал препаратам сравнения, но достоверно превосходил плацебо [12].
Более четко показать достоинства целекоксиба при купировании зубной боли удалось в работе Cheung R. и сотр. В ходе этого РКИ 171 больной, испытывающий умеренную или выраженную боль после экстракции 3–го моляра, однократно получил целекоксиб 400 мг, ибупрофен 400 мг или плацебо. Оба НПВП демонстрировали значительное превосходство над плацебо – в частности, после приема препаратов облегчение боли в среднем было отмечено через 28 и 26 минут соответственно. При этом целекоксиб действовал намного дольше: в среднем повторное обезболивание пациентам, получившим этот препарат, потребовалось больше чем через сутки, в то время как после приема ибупрофена через 10 ч. 58 мин. а плацебо – через 1 ч. 51 мин. [13].
При умеренно выраженной острой боли, связанной с ограниченным хирургическим вмешательством, целекоксиб в качестве монотерапии не уступает «мягким» опиоидным препаратам. Такой результатат, в частности, был показан Gimbel J. и сотр. которые провели анализ данных двух однотипных РКИ, в которых определялся сравнительный анальгетический потенциал целекоксиба и опиоидного препарата оксикодона у больных после небольших ортопедических операций. Исследуемую группу составили 418 больных, получавших целекоксиб 200 мг или оксикодон 10 мг + парацетамол 1 г однократно и затем 2–3 раза в сутки «по требованию» в течение 5 дней. Согласно полученным результатам целекоксиб оказался достоверно эффективнее оксикодона. Так, дополнительное обезболивание потребовалось 12 и 20% больных соответственно (p<0,005), при этом опиоидный препарат достоверно чаще вызывал побочные эффекты – 43 и 89% соотвественно (p=0,001) [14].
В 2004 г. независимо друг от друга, были опубликованы 2 крупных обзора по использованию коксибов (в т.ч. целекоксиба) для послеоперационного обезболивания. Эти работы основывались на анализе данных 33 и 18 РКИ соответственно, в которых оценивалось анальгетическое действие коксибов в сравнении с плацебо, н–НПВП и «мягкими» опиоидными препаратами [16,17]. Авторы обзоров сделали вывод, что коксибы обеспечивают эффективное обезболивание при небольших вмешательствах (в частности, после стоматологических манипуляций), сопоставимое с действием «традиционных» НПВП, и равное или превышающее эффект «мягких» опиоидов (трамадола, кодеина и др.) в комбинации с парацетамолом. В качестве дополнительного обезболивающего средства после больших хирургических операций, коксибы потенцировали более мощное и пролонгированное действие основных методов аналгезии – таких, как парентеральное введение мощных опиоидов или эпидуральная анестезия [15,16].
Большой интерес представляет работа Straube S. и сотр. представляющая собой метаанализ 22 РКИ (всего 2246 больных), в которых оценивалась эффективность коксибов для предоперационного обезболивания. Коксибы (в т.ч. целекоксиб, обычно в дозе 200 мг) назначались за 30–60 минут до и в течение первых суток после операции. По сравнению с плацебо при применении целекоксиба был получен четкий клинический эффект, выражавшийся в значимом уменьшении послеоперационных болей, снижении потребности в назначении опиоидов, удовлетворенности больных уровнем анальгезии. Важно отметить, что в отличие от иных НПВП использование коксибов не сопровождается существенным увеличением риска послеоперационных кровотечений [17].
Parsa A. и сотр. продемонстрировала близкие данные. Они оценили эффективность целекоксиба в группе 695 женщин, прошедших хирургические операции на молочных железах. Целекоксиб назначался в дозе 400 мг за 30 мин. до оперативного вмешательства. В отличие от плацебо такая тактика обезболивания позволила статистически значимо сократить потребность в послеоперационном применении опиоидных анальгетиков (р=0,001) [18].
Nikanne E. и сотр. оценивали эффективность целекоксиба 200 мг, кетопрофена 100 мг и плацебо для обезболивания при проведении тонзилэктомии у 120 амбулаторных пациентов. Препараты назначались в дозе 200 и 100 мг за 1 час до операции и через 1 час после. Эффективность обезболивания была достоверно выше, чем при использовании плацебо, в обеих лечебных группах и не различалась у получавших целекоксиб и кетопрофен. Однако на фоне целекоксиба отмечался лишь 1 эпизод значимого послеоперационного кровотечения, в то время как при использовании кетопрофена – 6 подобных эпизодов [19].
Эффективность целекоксиба в качестве средства «скорой помощи» подтверждает мета–анализ Derry S. и сотр. оценивших результаты 8 РКИ (всего 1380 больных). Однократное применение целекоксиба 200 и 400 мг обеспечивало значимое снижение интенсивности острой послеоперационной боли и существенно превосходило плацебо. Так, потребность в повторном обезболивании отмечалась в среднем через 6,6, 8,4 и 2,3 часа после применения целекоксиба 200, 400 мг или плацебо. Индекс NNT – число больных, которых надо было пролечить, чтобы получить значимое (как минимум, на 50%) облегчение боли, составил соответственно 4,2 и 2,5 для различных дозировок препарата [20].
НПВП являются препаратами выбора для анальгетической терапии при острой скелетно–мышечной патологии. Так, эти препараты – наиболее популярное средство для купирования острой боли в нижней части спины (БНЧС), которая является одной из наиболее частых причин экстренного обращения за терапевтической помощью.
При острой БНЧС целекоксиб зарекомендовал себя как эффективное и вполне безопасное средство. Прекрасная тому иллюстрация – работа Dietrich I. и сотр. (2006), в которой проводилось сравнение эффективности целекоксиба 400 мг/сут. и диклофенака 150 мг/сут. у 244 больных БНЧС. Критерием включения было наличие сильных болевых ощущений (ВАШ >50 мм). Через 3 и 7 дней лечения отмечалось значительное снижение боли в обеих группах, при этом эффект препаратов достоверно не различался: – 40,0 мм vs –42,6 мм и –58,8 мм vs – 60,7 мм по ВАШ соответственно. Но при этом на фоне приема диклофенака число осложнений со стороны ЖКТ было достоверно большим [21].
Есть данные о высокой сравнительной эффективности целекоксиба при лечении такой острой патологии, как плечелопаточный периартрит и субакромиальный бурсит. Соответствующее исследование было проведено Petri M. и сотр. В ходе работы 306 больных с данной патологией в течение 14 дней принимали целекоксиб 400 мг, напроксен 1000 мг или плацебо. В конце периода наблюдения лишь на фоне приема целекоксиба отмечалось достоверно значимое (по сравнению с плацебо) снижение выраженности боли – в среднем на 35,0±3,06 мм по ВАШ. При этом эффективность напроксена не превосходила плацебо [22].
Одной из важных причин развития периодической острой боли в современной популяции является дисменорея. НПВП при этой патологии весьма эффективны, и целекоксиб не уступает по своему лечебному потенциалу другим представителям этой лекарственной группы. Подтверждением этого могут считаться 2 однотипных РКИ (n=149 и 154), в которых изучалось лечебное действие целекоксиба (400 мг однократно и затем по 200 мг 2 раза в сутки), или напроксена (550 мг однократно и затем по 550 мг 2 раза в сутки) у больных с дисменореей, в течение 3–х дней. Эффективность обоих НПВП не различалась, но существенно превосходила плацебо [23].
Серьезной проблемой, связанной с использованием НПВП, является риск развития опасных лекарственных осложнений. Прежде всего, речь идет о патологии верхних отделов ЖКТ, так называемой «НПВП–гастропатии». Это осложнение развивается вследствие системного негативного влияния этих препаратов на защитный потенциал слизистой оболочки (что связано с блокадой ЦОГ–1 и снижением синтеза цитопротективных ПГ) и проявляется эрозиями, геморрагиями, язвами и ЖКТ – кровотечением. НПВП–гастропатия возникает независимо от лекарственной формы НПВП, поэтому их применение в виде свечей или внутримышечных инъекций (вопреки устойчивому мнению некоторых врачей) не может считаться методом профилактики этой опасной патологии [1].
Подавляющее большинство эпизодов серьезных ЖКТ–осложнений, возникающих на фоне приема НПВП, возникает у больных с факторами риска, к которым относятся язвенный анамнез, пожилой возраст и сопутствующий прием лекарств, влияющих на свертывающую систему крови (низкие дозы ацетилсалициловой кислоты, иные антитромбоцитарные препараты, прямые и непрямые антикоагулянты) [1,24,25].
Хотя НПВП–гастропатия в большей степени является проблемой длительного применения НПВП, тем не менее она может быть актуальна и в случае их кратковременного использования для ургентного обезболивания. Хорошо известно, что при наличии серьезных факторов риска НПВП–индуцированные язвы и кровотечения могут возникать в первые же дни приема этих лекарств, а порой даже после однократного их назначения [1,24,25].
Применение в качестве обезболивающего средства с–НПВП позволяет существенно снизить опасность подобного осложнения. Как было отмечено выше, эти препараты характеризуются существенно лучшей гастродуоденальной переносимостью и низкой частотой развития язв и кровотечений. Так, во всех представленных в настоящем обзоре исследованиях на фоне приема целекоксиба не было зафиксировано ни одного случая развития серьезной патологии верхних отделов ЖКТ.
Другим клинически значимым осложнением, затрудняющим использование НПВП при острых травмах и после хирургических операций, является риск развития кровотечения. Это происходит как следствие способности НПВП подавлять агрегацию тромбоцитов за счет обратимой блокады ЦОГ–1, приводящей к снижению синтеза тромбоксана (ТхА2). У пациентов, не имеющих существенных нарушений свертывающей системы, этот механизм компенсируется параллельным снижением синтеза простациклина (PGI2) эндотелиальными клетками (ЦОГ–2 зависимый процесс) и не приводит к существенным нарушениям коагуляции. Однако в ситуациях, сопровождающихся массивным повреждением ткани и системным выбросом факторов, влияющих на свертывающую систему (в т.ч. простациклина). А именно к такой ситуации относятся серьезные травмы и хирургические операции, применение НПВП может привести к дисбалансу системы PGI2/TхA2 и антикоагулянтным сдвигам [26,27].
Ч
астота кровотечений из области операционной раны у больных, получавших НПВП, превышает 1% [28–30], хотя в большинстве случаев имеет низкую интенсивность и не требует повторного хирургического вмешательства или гемотрансфузии. Это демонстрируют данные наиболее крупного исследования безопасности НПВП, используемых для послеоперационного обезболивания. В РКИ было включено 11245 больных после «больших» хирургических операций. Пациенты группы I получали кеторолак (парентерально 1–2 дня до 90 мг/сут. затем 1–7 дней перорально до 40 мг/сут.), группы 2 – диклофенак (парентерально 1–2 дня до 150 мг/сут. затем 1–7 дней перорально до 150 мг/сут.), группы 3 – кетопрофен (парентерально 1–2 дня до 200 мг/сут. затем перорально 1–7 дней до 200 мг/сут.). Частота послеоперационных кровотечений составила 1,1, 1,4 и 0,6% соответственно (НД). При этом ЖКТ–кровотечения возникли лишь у 4–х больных [31].
Как показали данные этого исследования, наиболее важными факторами риска развития послеоперационного кровотечения на фоне использования НПВП оказались большой объем оперативного вмешательства, наличие исходных гемокоагуляционных нарушений и введение антикоагулянтов – таких как низкомолекулярный гепарин, причем использование последних увеличивает опасность кровотечения в 2–3 раза.
с–НПВП в отличие от «традиционных» НПВП практически лишены этого недостатка, поскольку не подавляют ЦОГ–1–зависимый синтез ТХА2 и не нарушают функцию тромбоцитов. Их суммарное действие на свертывающую систему крови следует расценивать, скорее, как прокоагулянтное. Имеются исследования, показавшие, что у больных, перенесших хирургические операции и получавших целекоксиб, кровотечения из области хирургической раны возникали существенно реже, чем у получавших н–НПВП [19,30]. Например, в уже упомянутом выше исследовании Nikanne E. в котором оценивалась эффективность и безопасность НПВП у больных, перенесших тонзилэктомию, кровотечение из области операции отмечалось лишь у 1 больного на фоне приема целекоксиба и у 6 больных, получивших в качестве обезболивающего средства кетопрофен [19].
Данные мета–анализа 52 РКИ (n=4895), в которых сравнивалась эффективность и безопасность различных НПВП для периоперационного обезболивания, также позволяют говорить о существенном преимуществе с–НПВП в плане снижения риска послеоперационного кровотечения. Так, на фоне приема «традиционных» НПВП хирургические кровотечения отмечались у 1,7%. Относительный риск (ОР) развития подобных кровотечений в сравнении с контролем (лицами, не получавшими после операции НПВП), составил 4,54 (1,54–13,4). Гастроинтестинальные кровотечения отмечались у 2,3% больных (ОР 5.12; 0,65–40,6). В то же время на фоне приема с–НПВП, кровотечений из области послеоперационной раны отмечено не было, а ЖКТ–кровотечения отмечались лишь у 0,7% больных. Вместе с тем была отмечена возможность развития на фоне с–НПВП умеренно выраженных нарушений функции почек – так, существенное повышение креатинина было отмечено у 1,4% больных [8].
В последнее время большое значение придается оценке риска кардиоваскулярных катастроф при использовании НПВП, и прежде всего эта проблема касается именно с–НПВП [1]. В отношении целекоксиба ситуация представляется достаточно спорной – многие авторы считают, что этот препарат, хотя и относится к классу «коксибов», тем не менее демонстрирует достаточно низкую частоту подобных осложнений [32–34]. В этом плане можно отметить относительно меньший риск дестабилизации артериальной гипертензии и сердечной недостаточности в сравнении с другими представителями данной лекарственной группы. Принципиально важно, что опасность развития инфаркта миокарда и ишемического инсульта существенно возрастает лишь при длительном использовании высоких доз НПВП [1]. При кратковременном использовании «коксибов» для купирования острой боли в том случае, если больные исходно не имели тяжелой ишемической болезни сердца, повышения риска кардиоваскулярных катастроф не отмечалось [35].
Учитывая данные клинических исследований, целекоксиб для купирования острой боли следует применять в однократной дозе 400 мг. Меньшая дозировка (200 мг) может быть использована для поддержания аналгезии и длительного лечения умеренно выраженной хронической боли. При этом очень интересным как с точки зрения эффективности, так и удобства для пациентов, представляется применение целекоксиба в качестве «превентивной аналгезии» – за 1–2 часа до предполагаемого хирургического вмешательства (например, удаления зуба) или болезненной процедуры.
Целекоксиб, как и другие НПВП, следует с осторожностью использовать у больных с серьезной патологией сердечно–сосудистой системы (прежде всего у больных ИБС), и пациентов с нарушением функции почек.
С другой стороны, целекоксиб выгодно отличает низкий риск развития опасных осложнений со стороны ЖКТ, что позволяет назначать его, например, пациентам с язвенным анамнезом или получающим антикоагулянты. В отличие от «традиционных» НПВП целекоксиб можно использовать, не опасаясь развития гипокоагуляционного кровотечения.
Таким образом, целекоксиб (Целебрекс), являющийся типичным представителем группы селективных ЦОГ–2 ингибиторов, представляется весьма действенным и достаточно безопасным средством для купирования острой боли самого различного генеза. Его эффективность в качестве ургентного анальгетика не вызывает сомнения: по выраженности обезболивания целекоксиб 400 мг не уступает иным популярным НПВП, таким как ибупрофен, кетопрофен, напроксен и диклофенак, а также «мягким» опиоидным анальгетикам. Важным его достоинством является длительное действие. Высокая биодоступность целекоксиба позволяет добиться облегчения боли уже через 30 минут после его перорального приема, что позволяет рассматривать его использование в качестве альтернативы столь популярному в нашей стране парентеральному применению НПВП.